細胞老化とテロメア構造の関係が明らかに
23.07.2018

Photo: geekwire
テロメアは、すべてのヒト染色体の末端にあるDNAセグメントで人間が年をとるにつれ、テロメアの長さは自然に減少していく。テロメアの短縮が、細胞分裂を止めることで細胞老化が生じる。シドニー大学の研究チームはテロメアの構造変化が細胞の老化を引き起こすことを発見した。癌から老化および心臓病に至るまで様々な細胞の健全な状態に影響を与える要因が解明できると期待されている。(Van Ly et al., bioRxiv, July 21, 2018 )
テロメア短縮は通常、癌細胞の異常成長を止める重要なしくみでもあるが、一部の人々は異常に短いテロメアで生まれ、そのため骨髄不全、肺線維症および高い癌率に悩まされている。テロメアの長さは、癌、心臓病、糖尿病などの病気のリスクの重要なマーカーで、テロメアのどのような変化が不健康な状態の原因かが焦点となっていた。
Credit: semanticscholar
テロメアが短くなると、染色体末端は壊れたDNAに似た状態になる。しかし、テロメアが年齢とともに健康状態から老化状態に変化する理由はよくわからなかった。この研究は根本的なその原因を特定したことで画期的な進展といえる。
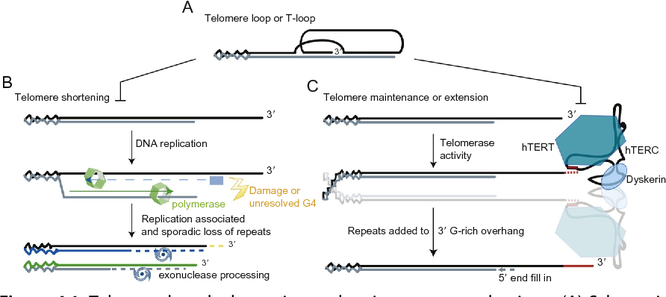
テロメアは細胞の老化現象を制御することは理解されていたが、研究チームの新しい研究では、テロメアを健康でない状態に変化させる原因を解明した。テロメアは、テロメアループと呼ぶループ構造を形成し、染色体の末端は隠れている。テロメアの末端部分はT-ループ(上図)と呼ばれる大きな環構造を形成しており、末端の突出部分はそれより手前の二本鎖部分に入り込み、D-ループと呼ばれる三重鎖構造を形成する。テロメアループが広がると、染色体の末端が露出し、細胞はこれをDNA破壊と認識する。
2014年のノーベル化学賞を受賞した超高解像顕微鏡法の出現により、顕微鏡下でテロメアループを観察することが可能になった。研究チームは超高解像顕微鏡と、細胞老化を模倣する遺伝子モデルを組み合わせた。TRF2(注1)が減少したネズミおよびヒト細胞では、T-ループ展開から線状化染色体末端への構造変化により、染色体末端でのATM-活性化が起こることがわかった(下図)。
(注1)テロメア結合タンパク質TRF2(テロメア反復結合因子2)。最近の研究でTRF2の過剰発現に発癌性があること、テロメラーゼの欠乏がこの腫瘍形成作用を劇的に強めることが報告されている。

老化の鍵となるテロメアループ
研究チームはテロメア長ではなく、テロメアループが形成されにくくなるテロメア構造が鍵となることを見出した。さらに、テロメアは、癌細胞を殺すのに役立ついくつかの化学療法剤に応答して構造を変化させることを明らかにした。テロメアの長さだけではなく、テロメア構造が細胞の健康状態を制御することとが明らかになったことで、研究チームは人間の健康とテロメア構造を関連付ける研究に着手する予定である。
関連記事:
